Xin chào các anh chị em Đồng Điệu,Mình tên là Lê Duy Kiên aka. Kiên Sinh, tốt nghiệp Cử nhân ngành CNSH (hệ Chất lượng cao) thuộc trường Đại học Khoa học Tự nhiên (ĐHQG TP.HCM). Hôm nay Kiên lại tiếp tục lên đây chém gió cùng cả nhà, mong những kiến thức này hữu ích cho ae Đồng Điệu.
Nicotinamide Mononucleotide (NMN) đã thu hút sự chú ý đáng kể trong những năm gần đây như một phân tử bổ sung tiềm năng, chủ yếu được quảng bá vì lợi ích chống lão hóa. Sự quan tâm này bắt nguồn từ vai trò thiết yếu của NMN như một tiền chất trực tiếp của Nicotinamide Adenine Dinucleotide (NAD+), một coenzyme quan trọng trong mọi tế bào sống.
NAD+ tham gia vào vô số quá trình sinh hóa, từ chuyển hóa năng lượng đến sửa chữa DNA và tín hiệu tế bào. Một cơ sở lý luận quan trọng cho việc bổ sung NMN là sự suy giảm nồng độ NAD+ được quan sát thấy trong quá trình lão hóa tự nhiên và trong một số bệnh lý liên quan đến tuổi tác. Việc phục hồi mức NAD+ thông qua các tiền chất như NMN được kỳ vọng sẽ giảm thiểu các rối loạn chức năng liên quan đến tuổi già.
Tuy nhiên, song song với sự phổ biến ngày càng tăng của NMN, những lo ngại và tuyên bố về mối liên hệ tiềm ẩn giữa việc bổ sung NMN và nguy cơ ung thư đã xuất hiện. Những lo ngại này không phải là không có cơ sở, vì NAD+ đóng vai trò trung tâm trong các quá trình tế bào mà các tế bào ung thư thường khai thác để tăng sinh và tồn tại. Đặc biệt, các tế bào ung thư thường thể hiện sự trao đổi chất NAD+ tăng cường để đáp ứng nhu cầu năng lượng và sinh tổng hợp cao.
Điều này tạo ra một nghịch lý:
“Liệu việc tăng cường NAD+ bằng NMN, vốn được nghiên cứu để chống lại sự suy giảm do tuổi tác, có thể vô tình thúc đẩy sự phát triển của ung thư hay không?”
Hãy cùng Kiên đào sâu và xem xét các bằng chứng tiền lâm sàng và lâm sàng hiện có, đồng thời thảo luận các yếu tố điều hòa tiềm năng, báo cáo này sẽ làm sáng tỏ thực tế khoa học hiện tại về mối quan hệ phức tạp giữa NMN và ung thư, phân biệt giữa những gì đã biết, những gì chưa chắc chắn và những khía cạnh cần nghiên cứu thêm nhen.
Warning: Bài này hơi dài, do Kiên sẽ đào sâu về các vấn đề sinh học xung quanh ung thư đó.
I/ Nền tảng về NMN và NAD+: Sinh hóa và vai trò tế bào
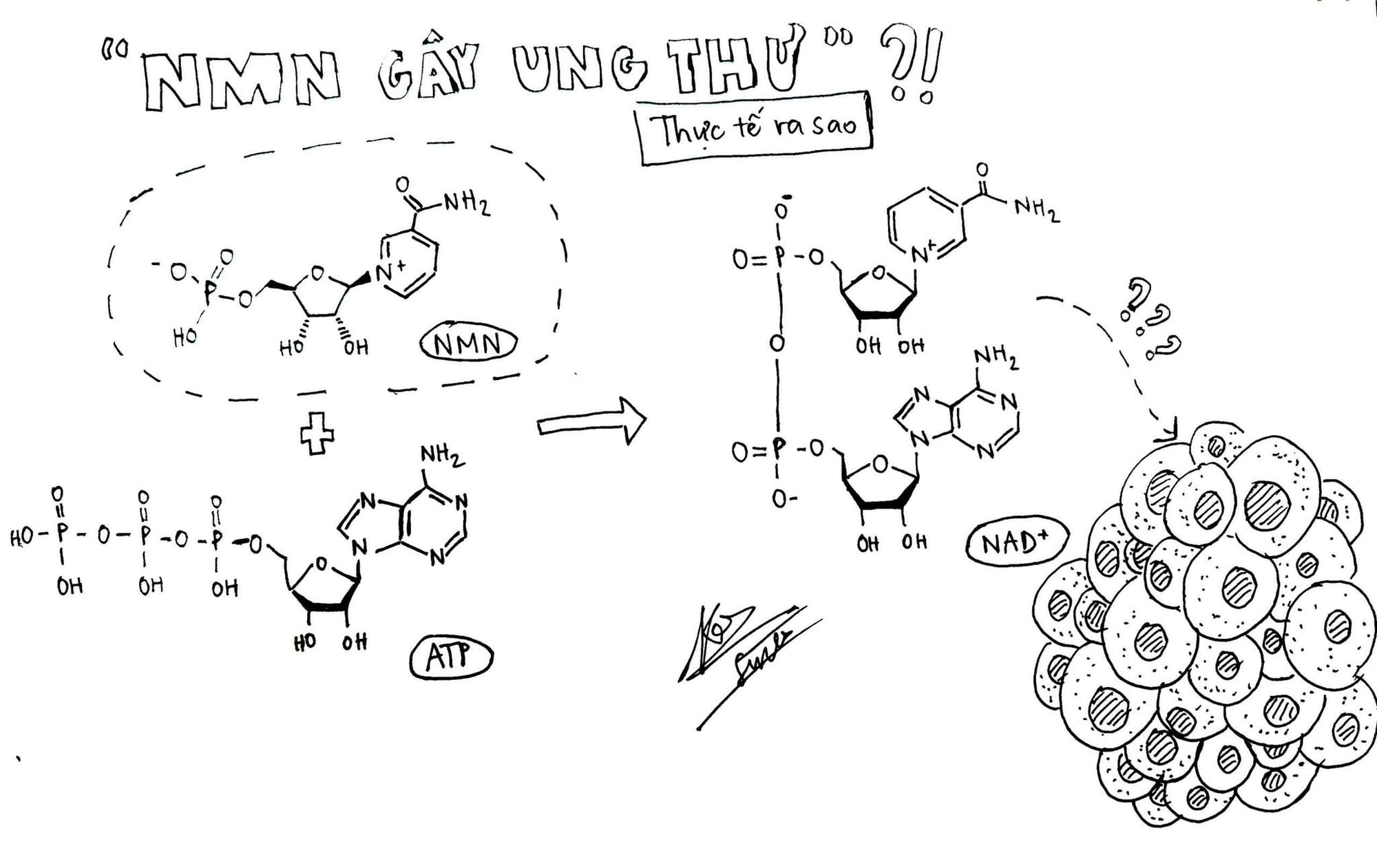
1. Định nghĩa và cấu trúc NMN
Nicotinamide Mononucleotide (NMN) là một nucleotide tự nhiên, có mặt trong mọi tế bào sống. Về mặt cấu trúc hóa học, NMN bao gồm ba thành phần chính: một nhóm phosphate, một phân tử đường ribose và một gốc nicotinamide (một dạng của vitamin B3).
NMN được tìm thấy trong một số thực phẩm tự nhiên như sữa bò, thịt, bông cải xanh, bắp cải, đậu nành lông và dưa chuột, mặc dù thường ở nồng độ tương đối thấp.
Thông tin thêm: Khối lượng phân tử của NMN là 334.221 g/mol và tồn tại dưới hai dạng đồng phân là alpha và beta, trong đó dạng beta là dạng có hoạt tính sinh học.
2. Các con đường sinh tổng hợp NAD+
Nồng độ NAD+ trong tế bào được duy trì thông qua một sự cân bằng qua lại giữa quá trình sinh tổng hợp, tiêu thụ và tái chế. Ở động vật có vú (bao gồm cả con người), có ba con đường chính tham gia vào quá trình sinh tổng hợp NAD+: Con đường Cứu vớt (Salvage Pathway), con đường Preiss-Handler và con đường De Novo (Tổng hợp từ đầu).
Chị Là Trang đã có một bài chia sẻ rất chi tiết về NAD+ á, các Đồng Điệu tìm đọc hiểu thêm về NAD+ hen. Kiên xin phép không nhắc lại nhen, vì bài này đã quá dài rồi :)))S
ự tồn tại của nhiều con đường sinh tổng hợp NAD+ phức tạp, liên kết với nhau cho thấy rằng việc cung cấp một tiền chất duy nhất như NMN không nhất thiết dẫn đến sự gia tăng đồng đều NAD+ ở mọi nơi trong tế bào và cơ thể. Sự phức tạp này có thể giải thích tại sao tác dụng của NMN có thể khác nhau giữa các mô hoặc tùy thuộc vào bối cảnh cụ thể.
3. Chức năng tế bào thiết yếu của NAD+
NAD+ đóng vai trò trung tâm trong nhiều chức năng tế bào cơ bản (Kiên xin phép lược bớt đoạn này để bài bớt dài nha. Nào rảnh hoặc ae hỏi thì Kiên sẽ giải thích sâu hơn ở phần bình luận nghen):
- Coenzyme (tức là các phân tử “hỗ trợ” cho enzyme chính) trong các phản ứng oxy hoá-khử nền tảng trong tế bào.
- Làm cơ chất cho hệ thống các enzyme tín hiệu như các sirtuin (SIRT), Poly(ADP-ribose) Polymerase (PARP), CD38, CD157 hay SARM1.
- Tham gia vào việc sửa chữa DNA và duy trì tính ổn định của bộ gen.
NAD+ nằm ở một giao điểm quan trọng, kết nối chuyển hóa năng lượng cơ bản (phản ứng oxy hoá-khử) với các quá trình điều hòa bậc cao hơn (sửa chữa DNA, biểu hiện gen, đáp ứng stress thông qua Sirtuin/PARP).
Vai trò kép này có nghĩa là việc thay đổi mức NAD+ thông qua NMN có thể gây ra các hiệu ứng lan tỏa và có khả năng đối nghịch nhau, tùy thuộc vào chức năng nào chiếm ưu thế trong một bối cảnh tế bào nhất định.
VD: Việc tăng NAD+ có thể vừa cung cấp năng lượng cho quá trình trao đổi chất (có khả năng thúc đẩy tăng sinh) vừa tăng cường các chức năng bảo vệ như sửa chữa DNA hoặc kích hoạt các con đường sirtuin cụ thể (có khả năng chống ung thư hoặc phụ thuộc vào ngữ cảnh). Các chức năng này có thể cạnh tranh với nhau để giành lấy nguồn NAD+, đặc biệt là trong điều kiện stress (cụ thể, tổn thương DNA cao kích hoạt PARP1, dẫn đến có thể làm cạn kiệt NAD+ cần thiết cho sirtuin hoặc chuyển hóa).
→ Do đó, kết quả cơ bản của việc bổ sung NMN rất khó dự đoán nếu không biết nhu cầu tương đối và độ nhạy của các quá trình phụ thuộc NAD+ cạnh tranh này trong một loại tế bào hoặc tình trạng cụ thể. Nói đơn giản, khá khó để đơn giản phán rằng “uống NMN gây ung thư” hay “uống NMN hạn chế ung thư” lắm.
II/ Chuyển hóa NAD+ trong bối cảnh ung thư
Mối liên hệ giữa NAD+ và ung thư rất phức tạp và đa chiều. Mặc dù NAD+ là thiết yếu cho sự sống của tế bào, các tế bào ung thư thường tái lập trình chuyển hóa NAD+ để hỗ trợ sự phát triển và tồn tại không kiểm soát của chúng.
1. Năng lượng tế bào ung thư và hiệu ứng Warburg: Nhu cầu NAD+
Một trong những đặc điểm nổi bật của chuyển hóa tế bào ung thư là "hiệu ứng Warburg", được mô tả lần đầu bởi Otto Warburg vào những năm 1920. Hiện tượng này đề cập đến việc các tế bào ung thư ưu tiên chuyển hóa glucose thông qua con đường đường phân (glycolysis) để tạo ra năng lượng (ATP) và lactate, ngay cả khi có đủ oxy cho quá trình phosphoryl hóa oxy hóa (một quá trình sinh năng lượng hiệu quả hơn nhiều trong ty thể).
Mặc dù đường phân tạo ra ít ATP hơn trên mỗi phân tử glucose so với phosphoryl hóa oxy hóa (2 ATP so với ~32 ATP), nó mang lại một số lợi thế cho tế bào ung thư:
- Tốc độ sản xuất ATP nhanh hơn: Đường phân có thể tạo ATP nhanh hơn phosphoryl hóa oxy hóa, đáp ứng nhu cầu năng lượng tức thời của các tế bào tăng sinh nhanh.
- Giảm sản xuất ROS: Phosphoryl hóa oxy hóa là nguồn chính của các loại gốc tự do oxy (Reactive oxygen species - ROS) nội bào. Bằng cách dựa vào đường phân, tế bào ung thư có thể giảm bớt gánh nặng stress oxy hóa.
- Cung cấp các khối xây dựng sinh tổng hợp: Các chất trung gian của đường phân có thể được chuyển hướng vào các con đường sinh tổng hợp quan trọng khác → Tối ưu hơn với nhu cầu cần lớn nhanh “thần tốc” của tế bào ung thư.
Quá trình đường phân phụ thuộc rất nhiều vào sự sẵn có của NAD+. Enzyme glyceraldehyde-3-phosphate dehydrogenase (GAPDH) yêu cầu NAD+ làm coenzyme để xúc tác một bước quan trọng trong đường phân, tạo ra NADH. Để duy trì dòng chảy đường phân, NADH phải được tái oxy hóa thành NAD+.
Trong điều kiện hiếu khí ở tế bào bình thường, NADH thường được đưa vào ty thể để tái oxy hóa thông qua sự phosphoryl hoá oxy hoá. Tuy nhiên, trong các tế bào ung thư thể hiện hiệu ứng Warburg, việc tái oxy hóa NADH chủ yếu xảy ra trong bào tương thông qua enzyme lactate dehydrogenase (LDH), enzyme này khử pyruvate thành lactate đồng thời oxy hóa NADH thành NAD+.
Do đó, để duy trì tốc độ đường phân cao, các tế bào ung thư cần một nguồn cung cấp NAD+ liên tục và dồi dào. Điều này dẫn đến việc nhiều loại ung thư biểu hiện mức độ cao của các enzyme trong con đường sinh tổng hợp NAD+, đặc biệt là NAMPT trong con đường cứu vớt (Salvage Pathway).
Sự biểu hiện quá mức của NAMPT thường được quan sát thấy trong các bệnh ung thư như đại trực tràng, buồng trứng, vú, dạ dày, tuyến giáp, tuyến tiền liệt, u thần kinh đệm và lymphoma ác tính và thường tương quan với sự tăng sinh tế bào, khả năng sống sót, giai đoạn bệnh tiến triển hơn, di căn, kháng trị và tiên lượng xấu.
Việc ức chế NAMPT bằng các chất ức chế đặc hiệu đã được chứng minh là làm cạn kiệt NAD+, ức chế sản xuất năng lượng và làm chậm sự phát triển của tế bào ung thư trong các mô hình tiền lâm sàng.
→ Nhu cầu cao về NAD+ của các tế bào ung thư theo hiệu ứng Warburg tạo ra một điểm yếu tiềm ẩn có thể bị khai thác, nhưng đồng thời cũng làm dấy lên mối lo ngại rằng việc cung cấp các tiền chất NAD+ ngoại sinh như NMN có thể vô tình cung cấp nhiên liệu cho sự phát triển của khối u bằng cách giảm bớt sự hạn chế về NAD+. Đây là một trong những cơ sở lý thuyết chính cho mối lo ngại "NMN thúc đẩy ung thư".
2. Bất ổn định bộ gen, sửa chữa DNA và NAD+ (liên quan đến các enzyme PARP)
a. Mặt tốt: NAD+ giúp sửa chữa DNA để ngăn đột biến sinh ung thư
Bất ổn định bộ gen là một đặc điểm cốt lõi của ung thư, dẫn đến sự tích tụ các đột biến và sắp xếp lại nhiễm sắc thể thúc đẩy quá trình hình thành và tiến triển của khối u. Các tế bào có các hệ thống sửa chữa DNA phức tạp để chống lại tổn thương DNA liên tục.
Enzyme PARP1 đóng vai trò trung tâm trong việc phát hiện và sửa chữa các đứt gãy sợi đơn DNA, một loại tổn thương phổ biến. Khi PARP1 phát hiện tổn thương DNA, nó sử dụng NAD+ làm cơ chất để tổng hợp các chuỗi PAR dài và phân nhánh trên chính nó và các protein khác tại vị trí tổn thương. Các chuỗi PAR này hoạt động như một tín hiệu thu hút các yếu tố sửa chữa DNA khác.Hoạt động này tiêu thụ một lượng đáng kể NAD+ trong nhân tế bào.
Trong trường hợp tổn thương DNA nghiêm trọng hoặc mãn tính, sự kích hoạt quá mức của PARP1 có thể làm cạn kiệt nghiêm trọng nguồn NAD+ nội bào. Sự suy giảm NAD+ này có thể làm suy yếu chức năng của chính PARP1 và các enzyme phụ thuộc NAD+ khác, bao gồm cả Sirtuin tham gia vào sửa chữa DNA (như SIRT1 và 6), dẫn đến việc sửa chữa DNA không hiệu quả và làm trầm trọng thêm tình trạng bất ổn định bộ gen.
Do đó, việc duy trì mức NAD+ đầy đủ là rất quan trọng để đảm bảo khả năng sửa chữa DNA hiệu quả và bảo vệ bộ gen, giúp giảm nguy cơ sinh ra ung thư.
b. Mặt không tốt lắm: NAD+ giúp tế bào ung thư “sống” lâu hơn
Mặt khác, nhiều tế bào ung thư, đặc biệt là những tế bào có khiếm khuyết trong các con đường sửa chữa DNA khác (VD: đột biến BRCA), lại phụ thuộc nhiều vào PARP1 để tồn tại. Trong những trường hợp này, việc ức chế PARP1 (thông qua giảm lượng NAD+ mà nó tiêu thụ) lại là một chiến lược điều trị ung thư hiệu quả (gọi là liệu pháp nhắm mục tiêu PARP). Các tế bào ung thư cũng có thể có tỷ lệ luân chuyển NAD+ cao hơn do hoạt động PARP tăng lên để đối phó với mức độ tổn thương DNA nội tại cao hơn.
→ Điều này tạo ra một nghịch lý liên quan đến NMN và ung thư:
- Việc tăng cường NAD+ bằng NMN có thể tăng cường sửa chữa DNA, có khả năng ngăn ngừa sự khởi phát ung thư bằng cách duy trì sự ổn định bộ gen.
- Tuy nhiên, trong các khối u đã hình thành, việc tăng cường sửa chữa DNA cũng có thể mang lại khả năng kháng lại các liệu pháp gây tổn thương DNA (như hóa trị, xạ trị) hoặc giúp tế bào ung thư tồn tại bất chấp sự bất ổn định bộ gen vốn có của chúng.
3. Tín hiệu phụ thuộc NAD+: Vai trò hai mặt của các sirtuin trong ung thư
Họ enzyme sirtuin (SIRT1-7) là một họ enzyme bảo tồn trong tiến hóa (tức là rất rất hiếm khi đột biến), sử dụng NAD+ làm cơ chất để loại bỏ các nhóm acyl (chủ yếu là acetyl) khỏi các gốc lysine trên protein histone và phi histone trong nhiễm sắc thể - một kiểu điều hoà di truyền học biểu sinh.Sự phụ thuộc vào NAD+ này cho phép sirtuin hoạt động như những cảm biến trao đổi chất, liên kết trạng thái năng lượng của tế bào với các phản ứng tế bào thích ứng. Sirtuin điều chỉnh một loạt các quá trình tế bào quan trọng, bao gồm biểu hiện gen, trao đổi chất, đáp ứng stress, sửa chữa DNA, chức năng ty thể và sự tồn tại của tế bào.Vai trò của Sirtuin trong ung thư cực kỳ phức tạp và thường có vẻ mâu thuẫn, với bằng chứng cho thấy chúng có thể hoạt động như cả chất ức chế khối u và yếu tố thúc đẩy khối u, tùy thuộc vào loại Sirtuin cụ thể, loại ung thư, giai đoạn phát triển, bối cảnh di truyền và môi trường vi mô.
- Hoạt động ức chế khối u:
- Duy trì ổn định bộ gen: SIRT1 và SIRT6 sửa chữa DNA, duy trì cấu trúc chromatin và telomere, ngăn đột biến gây ung thư. Mất SIRT6 làm tăng nguy cơ ung thư ở chuột.
- Ức chế chuyển hóa ung thư: SIRT3, SIRT4, SIRT6 chống lại hiệu ứng Warburg bằng cách thúc đẩy phosphoryl hóa oxy hóa, giảm gốc tự do ROS, ức chế HIF1α, chuyển hóa glutamine, và gen đường phân.
- Thúc đẩy chết rụng tế bào (apoptosis) hoặc sự lão hoá tế bào (senescence): Sirtuins có thể kích hoạt chết tế bào hoặc lão hóa để loại bỏ tế bào tổn thương, ngăn biến đổi ác tính. - Hoạt động thúc đẩy khối u:
- Ức chế chết rụng tế bào (apoptosis) hoặc sự lão hoá tế bào (senescence): SIRT1 bất hoạt p53 và FOXO, giúp tế bào ung thư sống sót.
- Thúc đẩy tăng sinh mạch: SIRT1 hỗ trợ hình thành mạch máu, cần cho khối u phát triển và di căn.
- Kháng thuốc: SIRT1 biểu hiện quá mức gây kháng hóa trị qua điều hòa gen kháng đa thuốc.
- Hỗ trợ chuyển hóa ung thư: SIRT5 thúc đẩy quá trình phân giải glutamine (glutaminolysis), quan trọng cho ung thư như đại trực tràng.
- Biểu hiện quá mức: SIRT1, SIRT2, SIRT5, SIRT7 tăng cao trong ung thư vú, tuyến tiền liệt, dạ dày, đại trực tràng, góp phần duy trì ác tính.
Sự phụ thuộc hoạt động của Sirtuins vào NAD+ có nghĩa là việc bổ sung NMN, bằng cách tăng mức NAD+, có khả năng điều chỉnh hoạt động của Sirtuin. Tuy nhiên, do vai trò hai mặt của hệ sirtuin trong ung thư, nó có thể nghiêng về phía ức chế hoặc thúc đẩy khối u tùy thuộc vào các con đường sirtuin nào chiếm ưu thế và có vai trò chức năng quan trọng hơn trong bối cảnh ung thư cụ thể đó.
→ Việc chỉ đơn giản nói rằng "NMN kích hoạt sirtuin" là không đủ; hậu quả cụ thể đối với ung thư là phức tạp và có khả năng mâu thuẫn.
4. Môi trường vi mô khối u: Chuyển hóa NAD+ và điều hòa miễn dịch
Môi trường vi mô khối u (Tumor microenvironment - TME) là một hệ sinh thái phức tạp bao gồm các tế bào ung thư, tế bào miễn dịch, nguyên bào sợi, mạch máu và chất nền ngoại bào, tất cả đều tương tác và ảnh hưởng đến sự phát triển, tiến triển và đáp ứng điều trị của khối u. TME thường có đặc điểm là các điều kiện khắc nghiệt như thiếu oxy, pH thấp (do tích tụ lactate từ hiệu ứng Warburg) và cạn kiệt chất dinh dưỡng, tạo ra một môi trường ức chế miễn dịch và thách thức trao đổi chất cho các tế bào miễn dịch chống khối u.
Chuyển hóa NAD+ đóng vai trò quan trọng trong việc điều hòa chức năng của các tế bào miễn dịch khác nhau trong TME. Các tế bào T (đặc biệt là tế bào T độc CD8+) và tế bào tiêu diệt tự nhiên là những tác nhân chính của hệ miễn dịch chống khối u. Hoạt động và chức năng hiệu quả của chúng đòi hỏi sự tái lập trình trao đổi chất đáng kể - bao gồm cả việc tăng cường đường phân và chức năng ty thể, các quá trình này có thể bị ảnh hưởng bởi sự sẵn có của NAD+.
Sự cạn kiệt NAD+ hoặc sự gián đoạn chuyển hóa NAD+ trong các tế bào miễn dịch này do môi trường TME khắc nghiệt có thể dẫn đến tình trạng kiệt sức hoặc rối loạn chức năng, làm suy yếu khả năng kiểm soát khối u của chúng. NAD+ ngoại bào và NAMPT ngoại bào cũng có thể đóng vai trò tín hiệu trong TME, ảnh hưởng đến tình trạng viêm và tương tác giữa các tế bào.
→ Trong bối cảnh này, việc bổ sung NMN có thể có những tác động phức tạp lên TME.
- Một mặt, nếu NMN có thể tăng cường mức NAD+ trong các tế bào miễn dịch chống khối u (như tế bào T, tế bào giết tự nhiên), nó có thể cải thiện chức năng trao đổi chất, chống lại tình trạng kiệt sức do TME gây ra và tăng cường khả năng tiêu diệt khối u.
- Mặt khác, nếu NMN cũng làm tăng NAD+ trong các tế bào ung thư hoặc các tế bào miễn dịch thuộc nhóm ức chế, nó có thể có tác động ngược lại - tăng độ “bền” của khối u.
III/ Điều tra tiền lâm sàng về bổ sung NMN và ung thư: Tác động đa dạng và phụ thuộc bối cảnh
Các nghiên cứu tiền lâm sàng về bổ sung NMN cho thấy tác động đối với ung thư rất phức tạp, phụ thuộc vào liều lượng, loại ung thư, và mô hình thử nghiệm. Các cơ chế tiềm năng bao gồm: chống ung thư (gây ferroptosis, bảo vệ STAT1, tăng cường miễn dịch, giảm viêm) và thúc đẩy ung thư (cung cấp NAD+ cho chuyển hóa, kích hoạt một số sirtuin, tăng sửa chữa DNA).Trong các thí nghiệm in vitro, NMN có thể ức chế hoặc thúc đẩy sự tăng sinh tế bào ung thư tùy thuộc vào nồng độ và dòng tế bào.
- Ở nồng độ cao (100 mM), NMN ức chế sự phát triển của tế bào ung thư phổi (A549, SPCA1) và gan (HepG2) thông qua các cơ chế như gây ferroptosis (một kiểu chết rụng tế bào) hoặc kích hoạt con đường SIRT1/mTOR. Ngược lại, ở nồng độ thấp (10-20 mM), NMN lại thúc đẩy sự tăng sinh trong cùng các dòng tế bào này và trong tế bào ung thư dạ dày (AGS, MKN45).
- Trong mô hình u thần kinh đệm, tăng cường chuyển hóa NAD+ qua enzyme NMNAT thúc đẩy tăng trưởng khối u bằng cách ức chế sự chết rụng tế bào qua yếu tố trung gian p53.
- Ngoài ra, NMN có thể bảo vệ protein ức chế khối u (STAT1) trong điều kiện stress oxy hóa, cho thấy tác động phụ thuộc vào bối cảnh tế bào.
Trên mô hình động vật in vivo, NMN cũng cho kết quả không đồng nhất.
- NMN (500 mg/kg, tiêm phúc mạc) làm giảm gánh nặng khối u trong mô hình ung thư đại trực tràng liên quan đến viêm (AOM/DSS) và u thần kinh đệm bằng cách giảm viêm, stress oxy hóa, hoặc tăng cường miễn dịch chống khối u (qua tế bào NK và đại thực bào).
- NMN liều cao (100 mM, tiêm trực tiếp) ức chế khối u phổi thông qua ferroptosis (một kiểu chết rụng tế bào). Tuy nhiên, một số nghiên cứu gợi ý NMN có thể thúc đẩy khối u, như trong mô hình u thần kinh đệm (qua NMNAT) hoặc ung thư dạ dày (in vitro).
- Đáng chú ý, khi dùng cùng hóa trị (cisplatin, doxorubicin), NMN (180-500 mg/kg) bảo vệ mô bình thường khỏi tác dụng phụ mà không ảnh hưởng đến hiệu quả chống khối u. Các nghiên cứu dài hạn trên chuột (100-550 mg/kg/ngày, 12 tháng đến suốt đời) cho thấy NMN không làm tăng tỷ lệ hoặc mức độ nghiêm trọng của khối u, ngay cả ở dòng chuột có nguy cơ ung thư cao.
→ Do đó, không thể kết luận đơn giản rằng NMN gây hay ngăn ngừa ung thư nếu chỉ dựa vào dữ liệu tiền lâm sàng.
IV/ Đánh giá bằng chứng trên người về bổ sung NMN và ung thư: Hạn chế và thiếu dữ liệu
Việc chuyển dịch các phát hiện từ mô hình tiền lâm sàng sang con người luôn là một thách thức, đặc biệt đối với các can thiệp như bổ sung NMN có tác động sinh học rộng rãi. Hiện tại, bằng chứng trực tiếp trên người về mối liên hệ giữa NMN và ung thư còn rất hạn chế.
Các thử nghiệm lâm sàng chủ yếu tập trung vào an toàn, dược động học, và hiệu quả liên quan đến lão hóa hoặc chuyển hóa, với liều NMN từ 100-1250 mg/ngày trong thời gian ngắn (vài tuần đến 12 tuần). Kết quả cho thấy NMN an toàn, được dung nạp tốt, và tăng mức NAD+ trong máu. Một số nghiên cứu ghi nhận cải thiện độ nhạy insulin, chức năng cơ bắp, hoặc sức khỏe tim mạch, nhưng tác động chuyển hóa tổng thể thường không rõ ràng khi so với giả dược.
Quan trọng, không có thử nghiệm lâm sàng nào đánh giá trực tiếp tác động của NMN lên tỷ lệ mắc, tiến triển hoặc tử vong do ung thư. Các nghiên cứu quan sát về nguy cơ ung thư ở người dùng NMN cũng chưa tồn tại.
Dữ liệu gián tiếp từ các nghiên cứu dài hạn trên chuột (không tăng gánh nặng khối u) mang lại một số trấn an, nhưng không thể ngoại suy trực tiếp sang người do khác biệt về sinh học và liều lượng.
→ Hạn chế chính bao gồm thời gian nghiên cứu ngắn, thiếu dữ liệu ở bệnh nhân ung thư và không có theo dõi dài hạn về biến cố ung thư. Sự khác biệt trong liều lượng, công thức và thiết kế nghiên cứu càng làm khó tổng hợp kết quả.
V/ Tạm kết
Dựa trên bằng chứng khoa học hiện có, khẳng định rằng NMN chắc chắn "gây ung thư" là không có cơ sở vững chắc. Mặc dù tồn tại những lo ngại lý thuyết do vai trò của NAD+ trong sự tăng sinh tế bào, dữ liệu tiền lâm sàng lại mâu thuẫn và bằng chứng trực tiếp trên người liên quan đến nguy cơ ung thư là không có. Các nghiên cứu dài hạn trên động vật không cho thấy sự gia tăng gánh nặng ung thư.
Tuy nhiên, những bất ổn đáng kể vẫn còn đó, đặc biệt là về việc sử dụng lâu dài ở người và tác động trong các bối cảnh ung thư cụ thể hoặc ở những cá nhân nhạy cảm. Do đó, cần phải có một cách tiếp cận thận trọng, nhấn mạnh sự cần thiết của các nghiên cứu nghiêm ngặt, dài hạn trên người trước khi có thể đưa ra kết luận cuối cùng về tính an toàn và hiệu quả của việc bổ sung NMN đối với ung thư.
"Thực tế" trong câu chuyện của NMN có gây ung thư hay không ở hiện tại là một thực tế phức tạp, phụ thuộc vào ngữ cảnh và thiếu nhiều dữ liệu đầy đủ.
Hy vọng bài viết của Kiên có ích với mọi người. Hẹn gặp lại cả nhà vào bài viết sau.
_________
Bài viết thuộc quyền sở hữu của Lê Duy Kiên, Kiên Sinh và group Đồng Điệu (Sống đơn thuần - Đẹp đơn giản). Đề nghị không sao chép dưới mọi hình thức khi chưa có sự đồng ý của tác giả.Bài viết độc lập, không được tài trợ bởi bất cứ nhãn hàng nào. Chỉ mang tính chất tham khảo. Không thể thay thế các nghiên cứu khoa học chính thống/hay lời khuyên y tế.













Discussion